新闻网讯(通讯员吴轩)全基因组关联研究(Genome-wide association studies, GWASs)是识别唇腭裂裂(OFC)相关遗传风险位点的最广泛的方法。然而,尽管队列规模不断增加,GWASs仍不足以检测所有的遗传力,这表明在目前严格的统计阈值下存在更多的关联。
8月25日,武汉大学口腔医学院/泰康生命医学中心刘欢副教授及口腔医学院陈智教授共同通讯在《国际口腔科学杂志》(International Journal of Oral Science,IF=25)在线发表题为“Chromatin conformation of human oral epithelium can identify orofacial cleft missing functional variants”(人口腔上皮的染色质构象可以识别口颌裂缺失的功能变异)的研究论文。
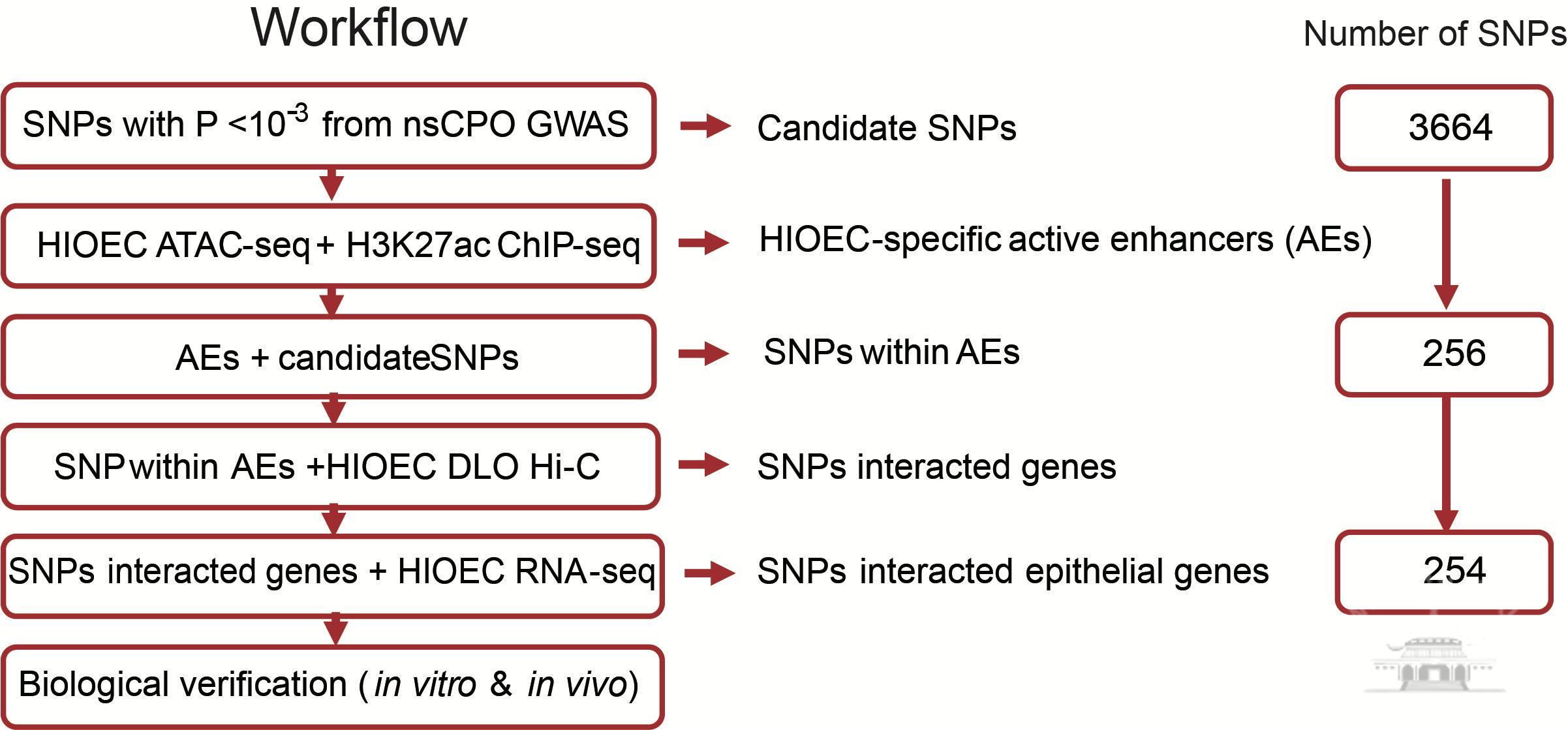
在本研究中,利用RNA-seq、ATAC-seq、H3K27ac ChIP-seq和DLO Hi-C获得了一个基于人口腔上皮细胞系(HIOEC)染色质构象的相对完整表观基因组数据集。据推测,该表观基因组数据集可以揭示口腔上皮细胞活性增强子/启动子中缺失的功能性变异及其风险靶基因,尽管与OFC的统计关联相对不那么严格。以中国汉族人群的非综合征性腭裂(NSCPO) GWAS数据为例,对3664个不能达到严格意义阈值的SNPs进行了该功能识别。
该功能注释共筛选到254个潜在的风险SNPs,它们位于与1718个口腔上皮表达基因启动子相互作用的顺式调控元件中。基于与上皮表达基因相互作用的增强子的Gapped k-mer机器学习,以及体内和体外报告基因分析作为功能验证。在所有潜在的SNPs中,该研究选择并证实了风险等位基因rs560789和rs174570通过阻止与上皮发育相关的转录因子结合来降低上皮特异性增强子的活性。总之,该研究建立了人类口腔上皮细胞的染色质构象数据集,并提供了一个框架,用于测试和理解调控变异是如何导致唇裂的风险。
非综合征性唇腭裂(NSOFC),特别是唇裂(CL)和腭裂(CP),是人类最常见的颅面先天缺陷,约700人中就有1人受影响,并代表着巨大的个人和社会负担。同时,关于相关遗传异常和染色体缺陷风险的准确信息对于帮助产前咨询是必要的。全基因组关联研究(GWAS)是一种研究与NSOFC产生有关的易感基因和遗传风险位点的不可知论方法,迄今为止已经从该研究中确定了40多个不同的基因/位点。然而,GWAS只能解释复杂性状遗传力的一小部分,这可能是因为影响不大的单核苷酸多态性(SNPs)没有达到严格的显著性阈值,而P <5 × 10−8通常被认为是显著的。此外,从GWAS图谱中识别出的大多数与基因组非编码区域相关的SNPs,只有不到三分之一的因果基因是与GWAS命中点最近的基因。因此,疾病相关SNPs的生物学注释具有内在的挑战性。对于功能验证,GWAS结果与功能表观遗传特征的综合分析有助于优先选择候选变异并确定分子机制。然而,尚未完全报道针对味觉的综合组织特异性表观基因组数据集。
唇腭裂源于异常的颅面发育过程,涉及腭上皮细胞和间充质细胞之间复杂而准确的相互作用。基因调控融合区上皮缝的形成和溶解以及周皮的分化与CP的发病机制有关。作者之前对斑马鱼周皮活性增强子DNA序列保守规则的识别,促进了人类OFC相关变异的下游功能验证的优先排序。课题组之前通过斑马鱼、小鼠以及人类组织的系统生物学研究显示,与其他常用的表观基因组数据集相比,人口腔上皮细胞产生的功能组学结果可以更加精准地注释与口腭裂相关的常见变异。为此,该课题组首先生成了人类口腔上皮细胞中基因表达、功能表观遗传特征和3D相互作用的集成数据集。作者从中国汉族人群的非综合征性腭裂(NSCPO) GWAS数据中选择了3664个P < 10−3的遗传变异作为候选SNPs。通过一系列生物学验证,该研究表明口腔上皮细胞增强子内的NSCPO相关SNPs致病碱基可以影响其与口腔上皮细胞中表达的基因启动子发生物理相互作用,限制细胞的增殖和迁移,最终产生更高的NSCPO风险。
武汉大学口腔医学院肖瑶博士和中国科学院大学水生物研究所/国家斑马鱼资源中心焦圣博博士为本论文共同第一作者,刘欢和陈智为论文共同通讯作者。华中农业大学农业微生物学国家重点实验室曹罡教授团队为该研究中三维基因组学研究提供技术支持。该工作受到了国家自然科学基金、湖北省青年拔尖人才培养计划和中央高校基础研究基金的资助。
论文链接:https://www.nature.com/articles/s41368-022-00194-0
(编辑:肖珊)