新闻网讯(通讯员韩玉芹)近日,国际学术期刊Molecular Therapy(《分子治疗》,IF: 11.454)在线发表病毒学国家重点实验室和湖北省细胞稳态重点实验室殷雷研究组在Cas12a脱靶研究取得的新成果。殷雷课题组博士后周进和陈鹏为共同第一作者,殷雷教授为通讯作者,该工作得到了国家科技部和国家自然科学基金的资助。
论文题为“Cas12a variants designed for lower genome-wide off-target effect through stringent PAM recognition”(《通过设计PAM严格识别的Cas12变体来降低其全基因组脱靶效应》),这是继该课题组2020年在Genome Biology(《基因组生物学》)上发表低脱靶CeCas12a之后的又一成果。
CRISPR-Cas系统是细菌抵御病毒入侵的免疫防御系统,对基因组能特异性识别和高效切割并在基因组编辑中得到广泛应用。相关报道表明,AsCas12a和LbCas12a是以TTTV为最佳PAM(protospacer adjacent motif)基序的基因编辑酶,但对含C的PAM(CTTV、TCTV、TTCV等)也会部分识别。
殷雷研究组长期关注病原识别和分子设计,前期从自然界鉴定并实验明确CeCas12a其严格的PAM识别和随后很低的脱靶效应(Chenet.al. genome biology.2020)。在该研究中,基于分子设计,在国际目前都集中在PAM识别扩展的背景下,反向设计使PAM识别严格,在具备自主知识产权的Lb2Cas12a和其他Cas12a基础上,研究组成功设计得到其PAM识别严格同时基因编辑效率依旧高效的多个变体,能同时编辑多个基因,在哺乳细胞全基因组上GUIDE-seq表明这些变体相较于野生型具有相当的基因编辑活性和更低的脱靶效应与染色体重排效应,并申请了相关专利。该研究为基因编辑酶的低脱靶人工设计改造提供了新的思路和候选分子。
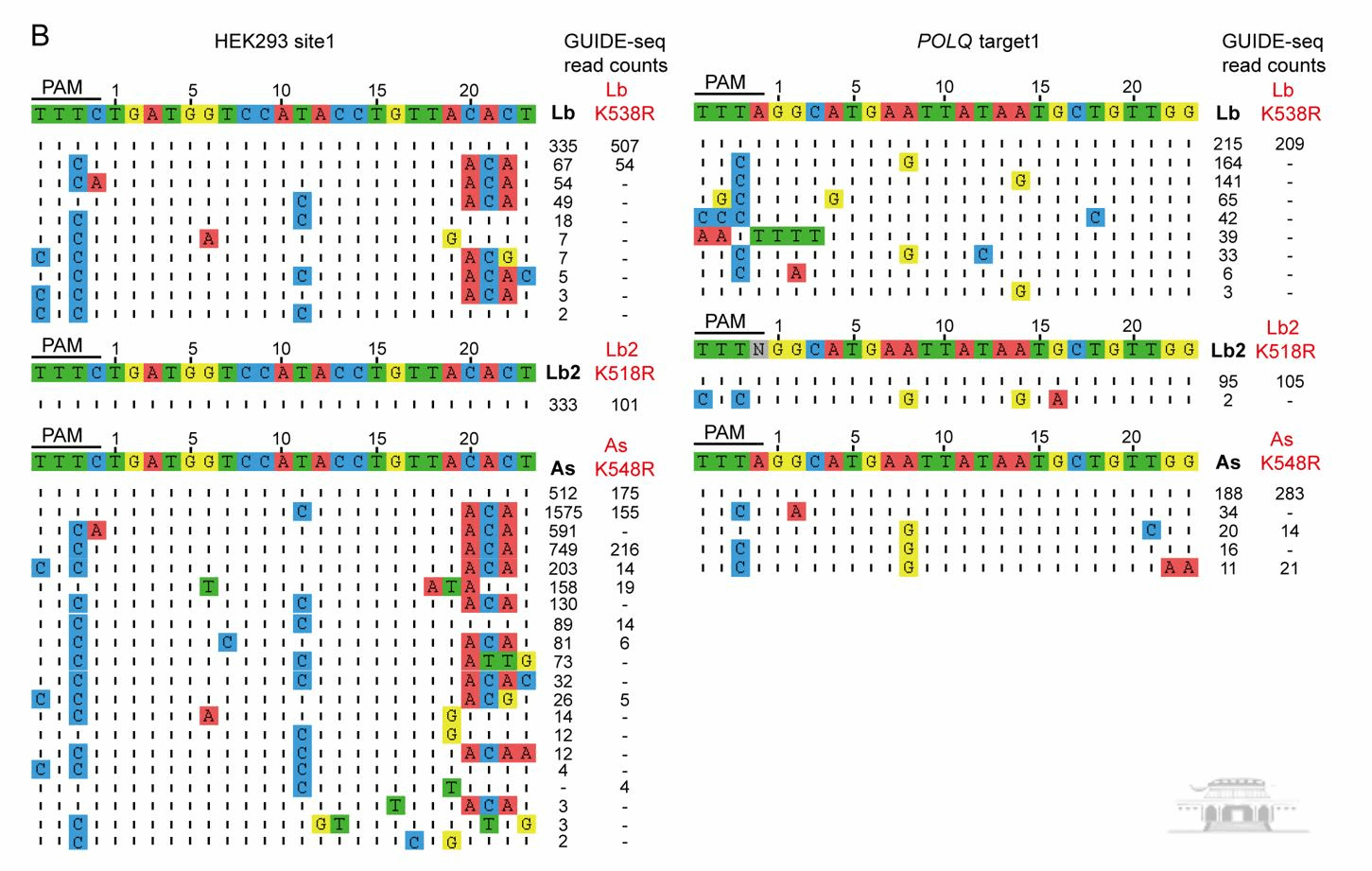
全基因组水平高通量测序分析各种编辑蛋白及其变体的特异性
原文链接:https://www.sciencedirect.com/science/article/pii/S1525001621005177
(编辑:肖珊)