新闻网讯(通讯员赵珺)2月,武汉大学医学研究院、教育部免疫与代谢前沿科学中心、泰康生命医学中心、病毒学国家重点实验室殷昊课题组在自然-化学生物学(Nature Chemical Biology)上发表了题为Fast and sensitive CRISPR detection by minimized interference of target amplification的研究论文。武汉大学医学研究院博士后佟晓晗、博士生张坤和武汉市金银潭医院转化医学中心副研究员韩阳为共同第一作者。

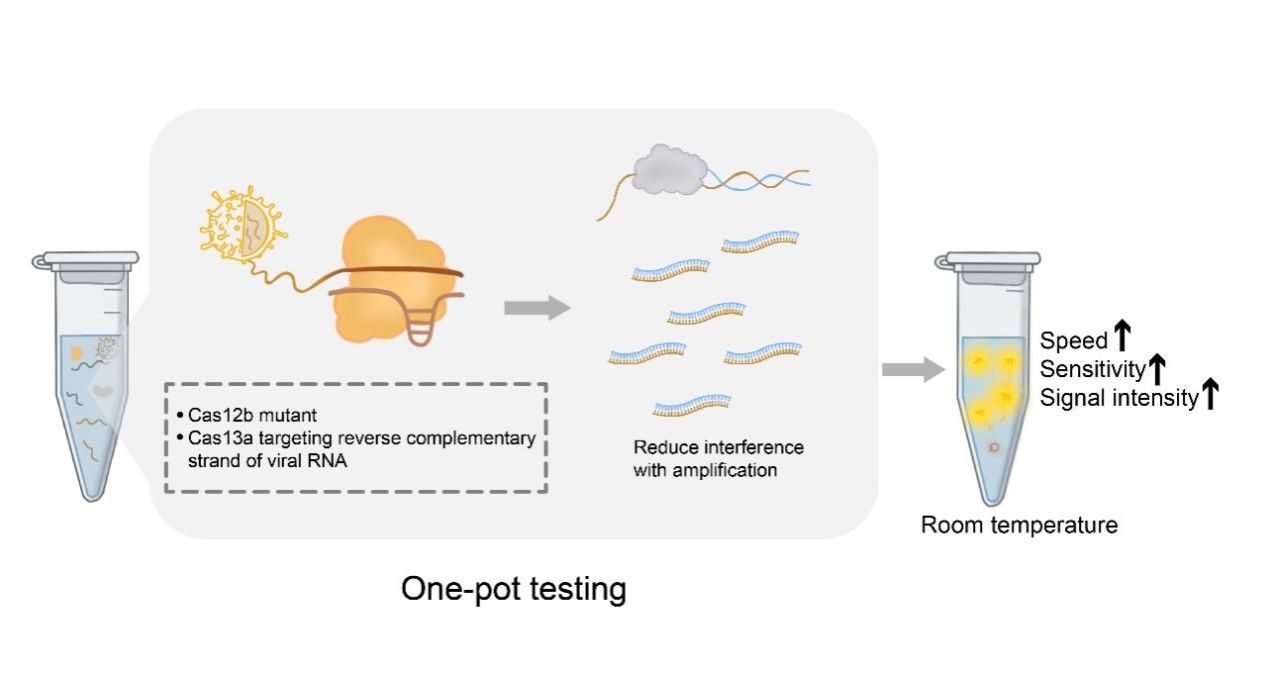
本研究通过深入解析影响基于Cas12b和Cas13a检测性能的分子机制,建立了无需温控装置的CRISPR检测方法,实现了在室温下进行快速且灵敏的检测。CRISPR-Cas12和Cas13具备一种称为反式切割的能力,当它们特异识别并切割核酸底物时(也称为顺式切割),这一过程可以激活其反式切割活性,在短时间内大量切割报告分子,快速释放荧光信号,实现特异信号的级联放大,使得它们在病原检测方面具有潜力。目前,FDA已批准了两种CRISPR检测产品,它们都利用了等温扩增来增加靶标片段的数量,然后再通过CRISPR对扩增后的靶点进行切割,从而释放荧光信号。然而,这些操作相对复杂,存在较高的交叉污染风险。为了简化步骤并降低污染的风险,一些研究者将等温扩增和CRISPR切割整合到一个反应体系中。但是,这种一步法反应时间较长且灵敏度低。此前,殷昊团队发表在Nature Biomedical Engineering的工作发现一步法反应中Cas12a蛋白的顺式切割过于强烈,会在反应初期消耗大量的扩增底物,从而干扰了等温扩增反应,延缓了检测反应的速度。通过使用Cas12a的非经典PAM,可减少顺式切割的影响,从而提高检测性能。
在本研究中,研究者们发现非经典PAM的策略并不适用于其他Cas蛋白,比如Cas12b。以Cas12b的三元复合物结构为指导,构建了AapCas12b蛋白突变体,发现通过降低Cas12b蛋白与底物的相互作用力,可以显著降低其顺式切割能力。在突变体介导的一步法检测中,其扩增子积累剂量提高了数倍至数百倍,检测灵敏度提高了10-10,000倍,仅需15分钟便能检测出0.5 cp/µL的RNA底物,灵敏度与RT-qPCR相当。对85个SARS-CoV-2真实样品的检出率达到100%。值得一提的是,Cas12b突变体使用的等温扩增技术为LAMP。相较于由三个酶组成的RPA等温扩增体系,仅使用单一酶的LAMP技术成本更低,临床转化潜力更大。
一步法核酸快检方法
抗原检测是广泛使用的自检方法,虽然灵敏度差,导致大量的假阴性结果,但可在室温下完成反应,不依赖于专业设备和温控装置,因此抗原检测的实际应用非常广泛。基于CRISPR的检测在应用中的受限因素之一是其依赖温控装置。本项工作致力于建立无需温控装置的CRISPR检测技术,扩大其应用范围。Cas13a具有卓越的反式切割能力,研究者们通过重新设计Cas13a靶标底物,降低Cas13a切割对逆转录和扩增过程的干扰,从而提高检测的稳定性和灵敏度。和此前发表的工作相比,新设计的一步法在灵敏度方面提高了1,000倍,反应速度也大为提升。通过进一步条件优化,实现了在20℃条件下,30分钟内检测出0.5 cp/µL的RNA样品,灵敏度与RT-qPCR相当,比抗原检测灵敏500-1,000倍,在自检方面具备应用潜力。
本研究获得武汉大学医学研究院仪器设备共享中心、武汉大学张楹课题组、金银潭医院王先广和中国科学院武汉病毒研究所周溪研究员的帮助。本项工作得到了湖北省重点研发计划、国家自然科学基金和科技部重点研发计划的资助。
原文链接:https://www.nature.com/articles/s41589-023-01534-9
(编辑:赵冀帆)