新闻网讯(通讯员高妍)近日,国际权威期刊Science Advances(《科学·进展》)在线发表了高等研究院陈素明教授与中南医院神经外科熊南翔教授在化学和临床医学方面的最新交叉科学研究成果。论文题为“Mechanistic Insight into Glioma Through Spatially Multidimensional Proteomics”(通过空间多维度蛋白质组学揭示胶质瘤的机制)。中南医院研究生沈磊和高等研究院研究生张周锐为共同第一作者,陈素明教授和熊南翔教授为共同通讯作者,武汉大学为论文唯一署名单位。该研究提出了一种创新的空间多维度蛋白质组学研究范式,应用于肿瘤的分子机制研究。论文发表后,美国的国际知名生物科技媒体GenomeWeb第一时间在其网站首页的“BreakingNews”栏目对本研究进行了大篇幅的报道。

肿瘤的分子机制研究是对其进行预防、诊断和治疗的关键。近年来,组学分析技术在肿瘤机制研究方面展现出了巨大的潜力,可以全景式的揭示肿瘤发生发展过程中分子层面的变化。其中,蛋白质组学可以提供蛋白质的全局视角,为阐明肿瘤的生物学机制提供重要信息。血液蛋白质组学在揭示机体的生理和病理状态以及寻找与疾病相关的生物标志物方面具有重要作用。然而,传统的研究模式是通过比较健康人和病人从同一部位采集的外周血来获得与疾病相关的分子指征。仅使用外周血进行机理研究和生物标志物发现有其固有的局限性。由于肿瘤局部分泌的失调蛋白会被血液循环稀释,与肿瘤相关的蛋白信息可能会被大量背景蛋白所掩盖。而从单一部位采集血液样本,很难获得蛋白质在机体的迁移和交换等信息。此外,研究对象具有个体差异性,利用对照组和疾病组之间的蛋白质组差异进行研究的传统方法很难找到特异的肿瘤标志物。因此,在肿瘤机制研究方面,亟需创新性的蛋白质组学研究范式。
神经胶质瘤是最常见的恶性脑肿瘤,而多形性胶质母细胞瘤是恶性程度最高、侵袭性最强的胶质瘤,导致患者预后不良。目前胶质瘤的发生和演化机制仍不清楚。虽然胶质瘤局限于脑部,但胶质瘤与其他系统或器官之间仍可能存在分子水平上的相互作用,尤其是病理状态下胶质瘤组织和血液之间的物质交换。基于此,提出一种新的范式来进行肿瘤机制研究(图1)。研究首先利用显微手术采集肿瘤局部环境的供血动脉和引流静脉的血液,血液中的肿瘤特征分子没有经过外周循环和稀释。再通过四维精准蛋白质组学技术,对肿瘤局部环境血液与病人自身的外周血进行比较蛋白组学研究。可以捕捉到局部血液中的细微特征变化,这些信息包含局部血液与肿瘤及其微环境的相互作用和物质交换,以及分子随血流的迁移特征。这种创新的空间血液蛋白组学策略将为揭示肿瘤发生发展的机制研究提供有力的手段。
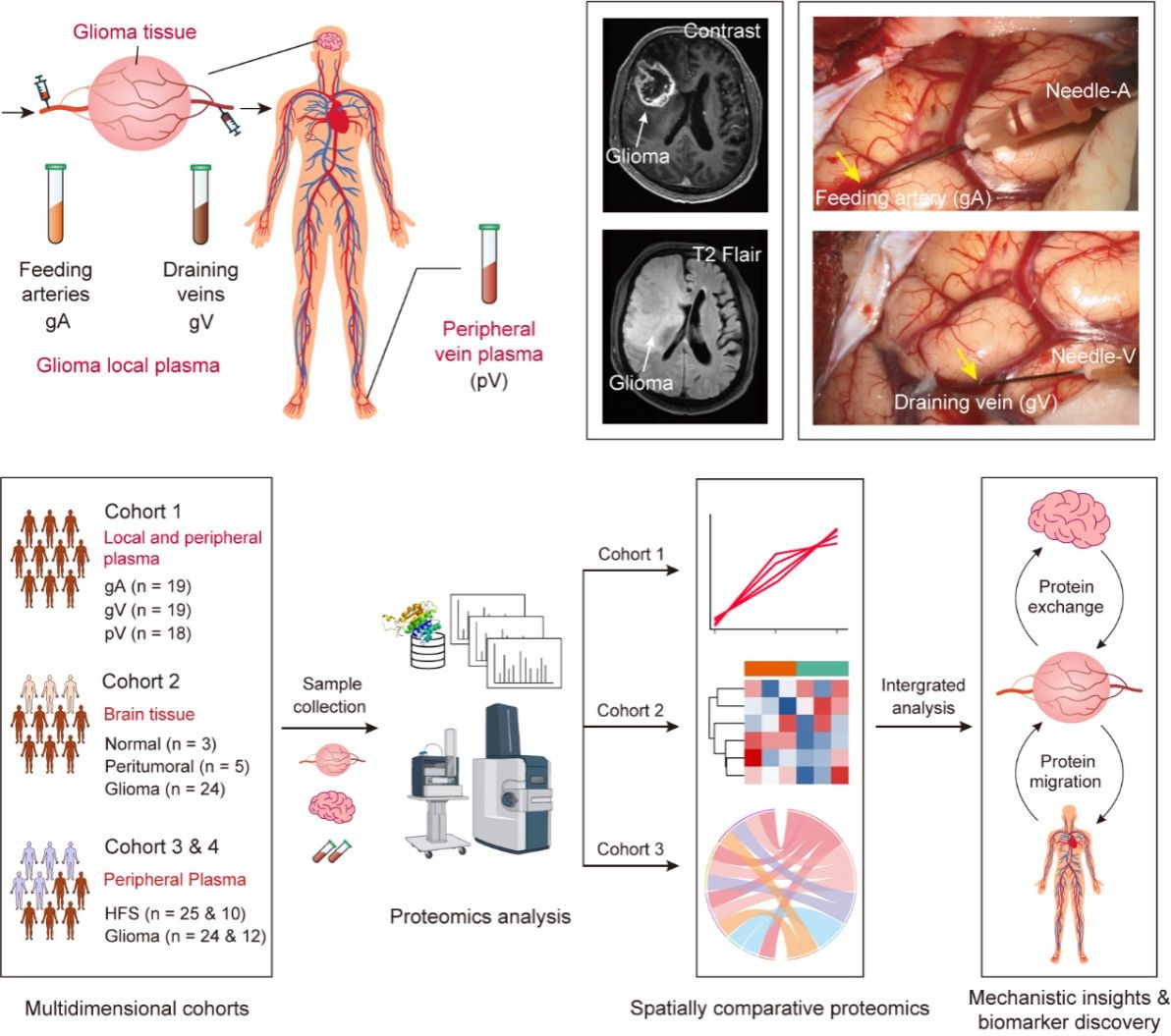
图1.利用空间多维度蛋白质组学策略进行胶质瘤的分子机制研究
研究以胶质瘤为例,通过肿瘤局部环境-外周血液蛋白质组学比较分析,并使用其它多个维度的临床队列(例如,组织、外周血等)进行交叉验证,发现了胶质瘤特有的分子变化(图2)。例如,实验中观察到胶质瘤局部血浆中丝氨酸蛋白酶抑制剂(如 SERPINA6)表达量显著较低。这意味着胶质瘤患者体内蛋白酶活性的负调控途径受到了抑制,而这在胶质瘤局部环境中更为明显。研究还发现参与错配修复通路的一种名为 PMS2P5 的蛋白质在胶质瘤微环境血浆中的表达远高于外周。通过与外周血浆和肿瘤组织中结果进行相互印证,揭示了胶质瘤的发生可激活DNA损伤修复系统。
此外,研究还发现一种重要的肿瘤抑制因子CRTAC1与胶质瘤之间存在相关性,并观察到CRTAC1在胶质瘤组织中的表达显著下调。进一步的DNA测序结果表明,胶质瘤组织中的CRTAC1基因在启动子区域产生了两个碱基(腺嘌呤)缺失的突变(突变率> 99%),这可能是导致其表达降低的原因。更为重要的是,研究发现血浆中的SERPINA6蛋白可作为胶质瘤的潜在生物标志物,实现对胶质瘤患者的诊断,灵敏度和特异性分别达到了87.5%和88.0%。这些发现全景式地揭示了胶质瘤导致的蛋白组变化,为这种恶性肿瘤的诊治提供了有价值的信息。同时,这种创新的研究策略也有望应用于其他肿瘤的机理研究。

图2.通过空间蛋白质组学发现的胶质瘤关键蛋白和相应的生物学通路
据悉,该研究得到了国家重点研发计划、国家自然科学基金、武汉大学科研启动基金等项目经费的支持。
论文链接:https://www.science.org/doi/10.1126/sciadv.adk1721
(学生编辑:师捷 编辑:张丽平)