新闻网讯(通讯员赵珺)日前,武汉大学医学研究院/免疫与代谢前沿科学中心崔逸仙课题组在国际学术期刊The EMBO Journal发表了题为“UVRAG cooperates with cargo receptors to assemble the ER-phagy site”的研究论文。该研究发现了一个新的内质网自噬调控分子,并深入解析了其分子机制。武汉大学医学研究院/免疫与代谢前沿科学中心崔逸仙教授为该论文独立通讯作者,博士研究生钱学红为第一作者。何林罡、杨杰杰、孙佳佳、彭雪盈、张玉婷及毛一舟同学为本课题的完成作出了贡献。
自噬是一种细胞内“自我清理”的生命过程,通过降解受损或冗余的细胞器、蛋白质、核酸等物质,来维持细胞功能与健康。内质网作为蛋白质、糖类、脂类合成与运输的重要细胞器,与肿瘤、代谢异常及神经退行性疾病等密切相关。内质网自噬对内质网稳态维持至关重要,但内质网自噬启动的分子机制仍不清楚。
该研究发现,在哺乳动物细胞中,抗紫外线辐射相关基因UVRAG能有效增强内质网自噬起始点(ER-phagy sites, ERPHS)组装,促进内质网自噬发生。机制上,研究者们发现UVRAG在内质网自噬中发挥了两种相互独立的功能(如图所示):一方面,氨基酸饥饿诱导UVRAG蛋白水平显著升高,UVRAG通过PR结构域结合内质网自噬受体蛋白而转位到内质网,促进受体寡聚化,增强受体对自噬核心蛋白LC3/GABARAP的募集,从而促使内质网片段断裂并被自噬小体包裹。另一方面,UVRAG通过CC结构域结合Beclin-1形成PI3KC3-II复合物,促进包含有内质网的自噬小体与溶酶体融合,进行降解。功能上,UVRAG介导的内质网自噬对异常堆积于内质网中的胰岛素突变型前体Akita有着高效的清除能力,此蛋白的积累已被证实与早发型糖尿病密切相关。
综上,该研究发现了UVRAG在内质网自噬中的关键作用,揭示了一种新的内质网自噬起始的分子机制。更重要的是,该研究提示内质网自噬可以降解异常积累于内质网的蛋白聚集体,可能成为潜在的靶点来治疗多种相关疾病,如神经退行性疾病和糖尿病等。
该研究依托于教育部免疫与代谢前沿科学中心,受到科技部重点研发计划和国家自然科学基金的资助,得到了武汉大学医学研究院/免疫与代谢前沿科学中心舒红兵教授、张楹教授和宋质银教授等多位学者的有力支持。
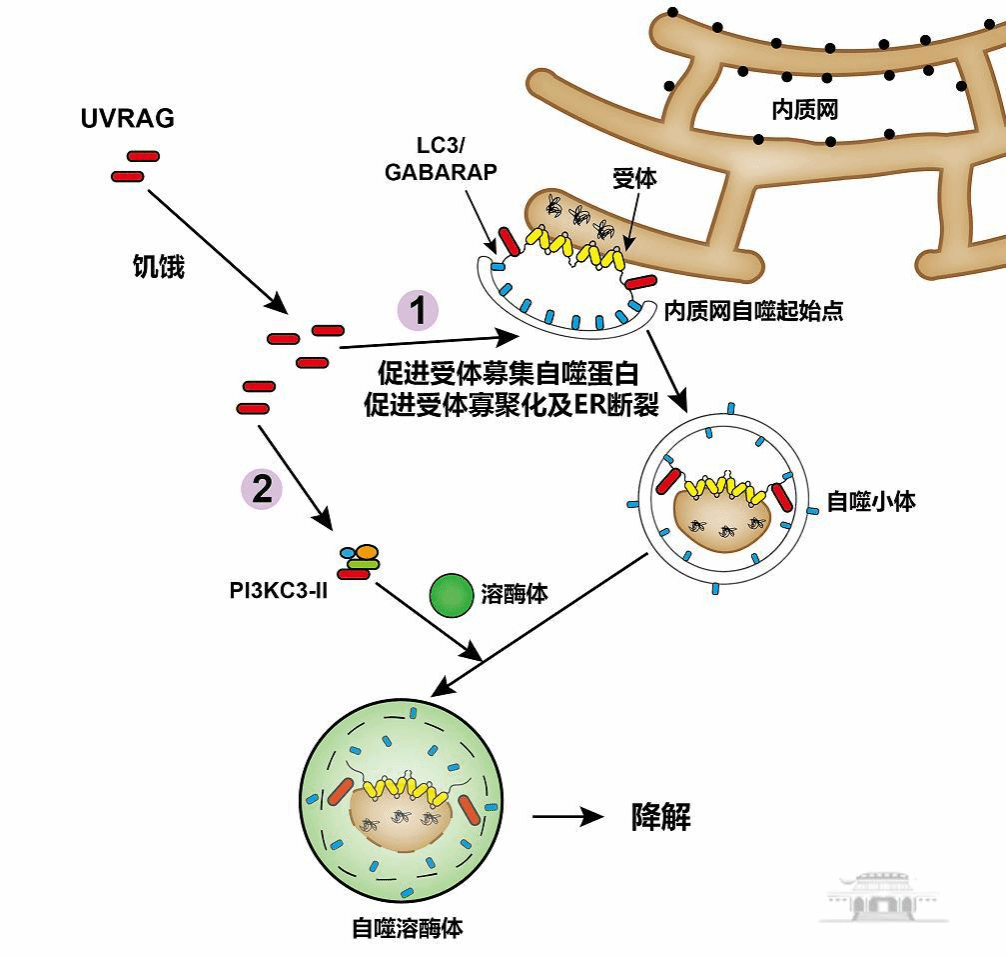
UVRAG介导内质网自噬分子机制示意图:①UVRAG结合受体蛋白来调控内质网自噬起始,②结合Beclin-1形成PI3KC3-II来促进自噬小体与溶酶体融合
论文链接:https://doi.org/10.15252/embj.2023113625
(实习编辑:刘昊 编辑:张丽平)