新闻网讯(通讯员赵珺)近日,武汉大学/中南医院医学研究院/免疫与代谢前沿科学中心周严课题组在国际学术期刊Nature Communications发表了题为“KDM2B regulates hippocampal morphogenesis by transcriptionally silencing Wnt signalingin neural progenitors”的研究论文。揭示了一个由KDM2B介导的调控海马发育的表观遗传学机制。博士研究生张博为该论文的第一作者,刘颖博士为共同通讯作者,天津医科大学吴旭东教授作出重要贡献。
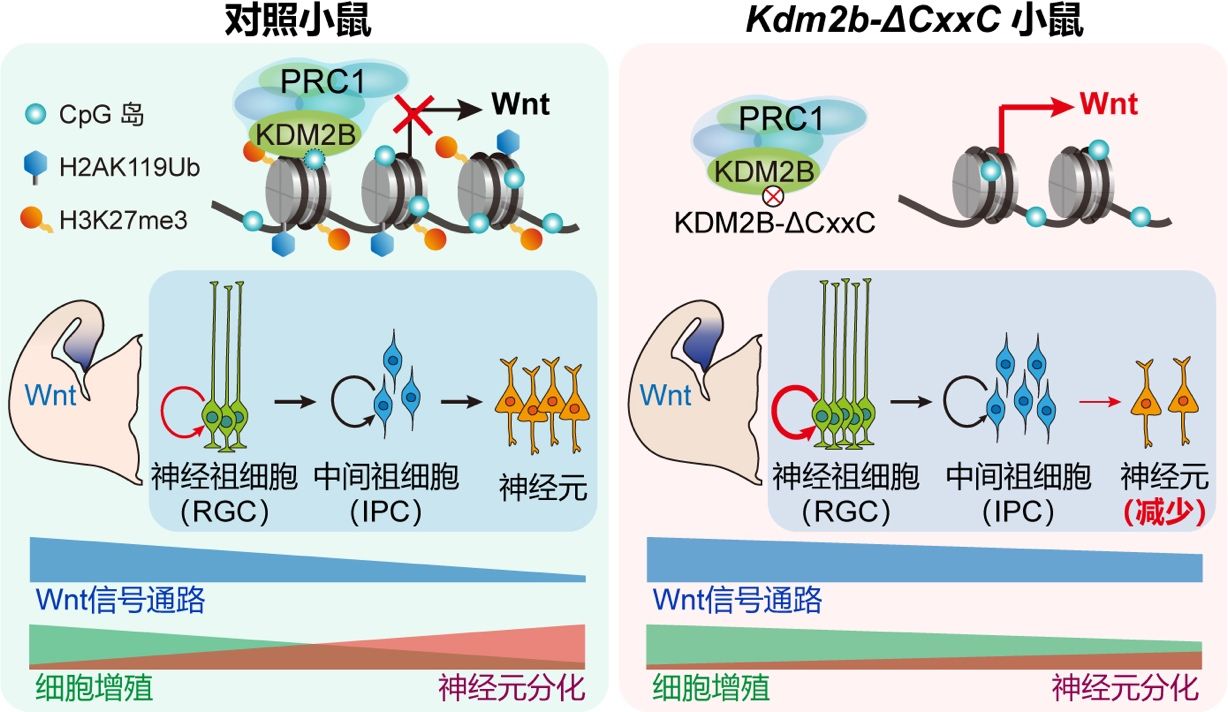
海马是大脑的重要结构,在学习、空间记忆和情感调节等发挥重要作用,其齿状回在成年阶段持续产生新生神经元。形成一个功能性的海马需要产生多种细胞类型,它们在发育过程中精确地迁移定位并形成功能环路。目前对于大脑皮层发育的研究较为充分,而对海马发育的细胞和分子生物学机制尚有很多空白。人和小鼠KDM2B基因的突变均与神经发育缺陷相关。KDM2B是非经典多梳抑制复合物PRC1的组分,其通过CxxC结构域在CpG岛(CGI)招募PRC1的其他组分,建立和维持基因抑制。在这项研究中,作者发现在发育中的小鼠背侧端脑特异删除KDM2B的CxxC结构域后,成年小鼠的海马显著变小、细胞结构紊乱;海马成体神经干细胞数量减少,神经发生过程减弱;小鼠的探索欲望减弱,运动学习和空间记忆能力缺陷,恐惧记忆能力减弱。KDM2B的功能失活导致海马发育过程发生显著缺陷:神经祖细胞发生迁移阻滞和分化障碍,分化后的颗粒细胞异位堆积;且作为细胞迁移支架的胶质细胞在海马伞连接处异常分布。
KDM2B的功能失活导致海马及其神经祖细胞的Wnt信号异常激活,KDM2B介导的抑制性组蛋白修饰H2AK119ub和H3K27me3在Wnt信号通路基因的富集显著减弱。而在发育的海马中激活Wnt信号通路使神经祖细胞分化和神经元迁移受阻。
机制模式图
该项研究依托于教育部免疫与代谢前沿科学中心,受到科技部重点研发计划和国家自然科学基金的资助。
原文链接:https://www.nature.com/articles/s41467-023-42322-2
(供图:医学研究院实习编辑:方锦年 编辑:张丽平)