新闻网讯(通讯员赵珺)7月27日,武汉大学医学研究院、免疫与代谢前沿科学中心、武汉大学中南医院张楹/殷昊教授课题组合作在Nature Biomedical Engineering上发表了题为Enhancement of the viability of T cells electroporated with DNA via osmotic dampening of the DNA-sensing cGAS-STING pathway的研究论文。武汉大学医学研究院研究生安静、云南大学生命科学学院研究生张川平、武汉大学医学研究院研究生邱厚圆和博士后张红霞为共同第一作者。张楹和殷昊为共同通讯作者。殷昊是泰康生命医学中心双聘PI。

研究者们发现cGAS-STING介导的天然免疫通路在电转双链DNA(dsDNA)诱导原代T细胞死亡中起着至关重要的作用,并揭示电转缓冲液的渗透压能够直接调节cGAS-DNA结合亲和力,进而影响cGAS-STING激活。利用等渗电转缓冲液可极大降低该通路的激活和细胞死亡,制备的CAR-T细胞数比商业电转多达20倍;相较于慢病毒构建的CAR-T, 编辑效率和表达量均提高3倍,杀肿瘤活力更高。
研究者们首先探究了不同类型DNA对T细胞内cGAS-STING激活的影响,包括质粒、线性长双链DNA、线性长单链DNA,短双链DNA和短单链DNA。结果显示,只有当电转质粒和线性长双链DNA时,T细胞的活力明显降低,cGAS-STING通路显著激活。当敲除cGAS或STING时,电转dsDNA的细胞活力显著提高,证明电转长双链DNA诱导原代T细胞死亡主要是由cGAS-STING通路激活导致。
由于cGAS-STING通路具有重要的生物学功能,因此研究者们尝试瞬时抑制cGAS-STING通路,以实现降低电转递送DNA产生的细胞毒性。在试验了小分子抑制剂和siRNA之后,发现STING小分子抑制剂H151无法抑制cGAS-STING激活,而使用siRNA敲低STING需要两次电转递送,对T细胞产生极大的刺激,导致大量细胞死亡。通过高通量筛选电转缓冲液和电转参数后,研究者们发现优化电转缓冲液能显著降低cGAS-STING的激活程度,并且能够有效提高T细胞活力和电转递送效率。进一步机制研究发现,电转缓冲液的渗透压能够调控细胞内cGAS与DNA的结合亲和力,进而影响第二信使2’3’-cGAMP的产生,最终调节cGAS-STING通路的激活。当电转缓冲液的渗透压为等渗时,cGAS-DNA的结合亲和力降低,仅产生少量2’3’-cGAMP,极大降低了cGAS-STING激活。最后,研究者们利用等渗电转缓冲液构建CAR-T细胞,该方法产生的CAR-T阳性细胞绝对数比使用商业电转缓冲液多达20倍。与传统的慢病毒递送相比,利用等渗电转缓冲液递送CRISPR构建CAR-T的效率更高,并且具有比慢病毒递送构建的CAR-T细胞更高的抗肿瘤活性。
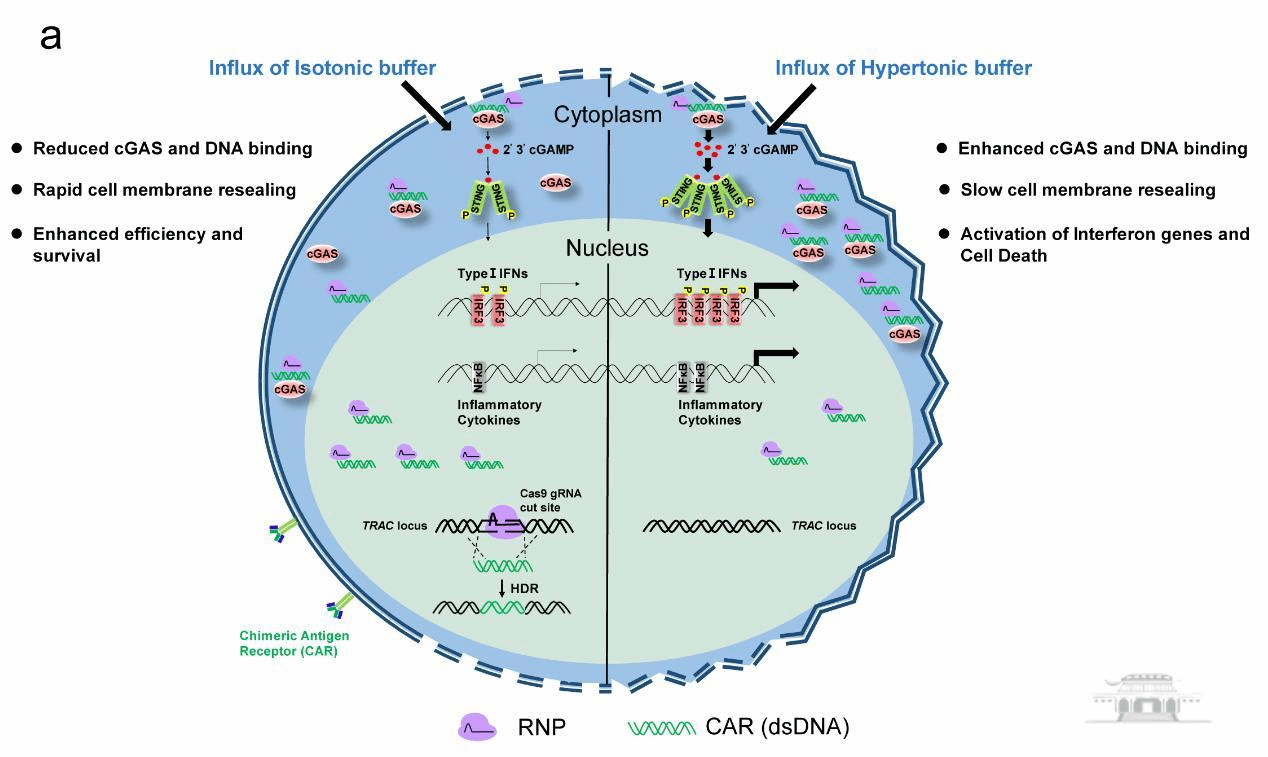
等渗电转缓冲液通过降低cGAS-STING激活,提高了T细胞的活力和CAR靶向插入效率
综上,研究发现cGAS-STING通路在电转DNA诱导T细胞死亡中起关键作用,并且揭示了电转缓冲液的渗透压通过调控cGAS-DNA的结合能力,进而影响了该通路的激活。基于该机制的发现,本研究开发了一种准确、高效且安全的递送方法用于构建更有效的CAR-T细胞。本研究为调控cGAS-STING通路的激活打开了新思路,为非病毒递送构建CAR-T的临床转化研究奠定了基础。随着进一步研究和实践,我们相信非病毒递送方法将在CAR-T细胞治疗领域取得更大的突破,为癌症患者带来更多希望和福音。
武汉大学医学研究院仪器设备共享中心为论文提供了硬件平台,及武汉大学舒红兵实验室提供了STING敲除小鼠。
原文链接:https://www.nature.com/articles/s41551-023-01073-7
(实习编辑:钟娴 编辑:张丽平)