新闻网讯(通讯员药轩)时隔一年,2023年11月15日,武汉大学药学院高帅教授、姚霞教授再度在Cell(《细胞》)杂志在线发表药物调控平滑肌/心肌钙离子通道Cav1.2的最新研究成果。文章题为“Structural basis for human Cav1.2 inhibition by multiple drugs and the neurotoxin calciseptine”(《多种药物及神经毒素calciseptine抑制人源钙离子通道蛋白Cav1.2的分子机制》)。研究揭示了自由状态、多种药物结合、多肽毒素结合的钙离子通道Cav1.2的高分辨结构。
武汉大学药学院高帅教授、深圳医学科学院院长颜宁教授、北京大学宋晨研究员为该文章共同通讯作者,武汉大学药学院高帅教授、姚霞教授、清华大学陈姣凤博士为该文章共同第一作者。武汉大学药学院为文章第一完成单位。清华大学化学系刘磊教授、圣约翰大学于勇教授为该工作提供了重要帮助。武汉大学泰康生命医学中心提供了科研经费支持。

电压门控钙离子通道Cav1.2是大脑、心肌和平滑肌L型钙通道的主要亚型,对许多生理与神经活动至关重要,如心肌和平滑肌收缩,以及学习和记忆功能等。Cav1.2功能异常增强与蒂莫西综合症有关,这是一种罕见的常染色体显性障碍,病理表现为心肌病、心律失常、蹼趾和自闭症谱系障碍等。Cav1.2是多种临床常用药物和天然毒素的作用靶标。
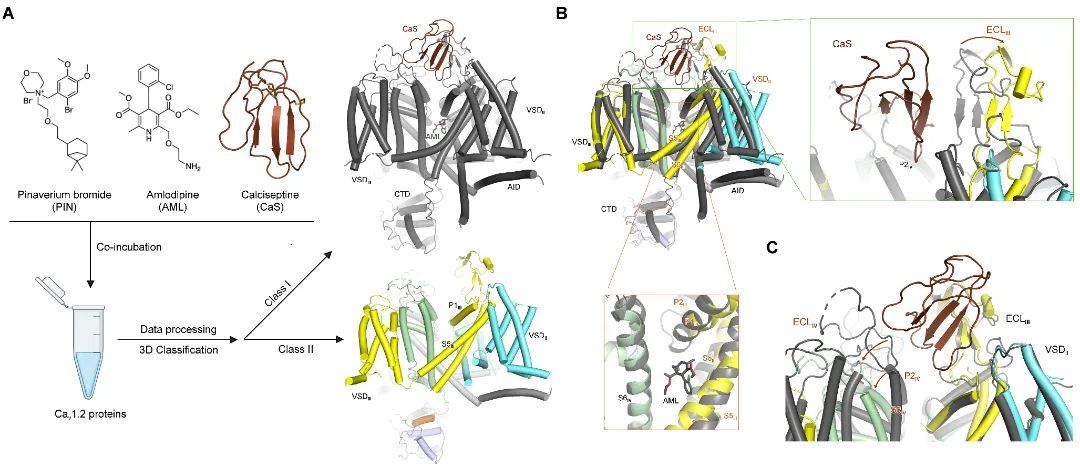
Calciseptine、匹维溴铵(Pinaverium)稳定Cav1.2蛋白两个完全不同的失活构象
无论是自由形式,还是与黑曼巴蛇毒素calciseptine、氨氯地平,胺碘酮与索非布韦结合,Cav1.2通道都呈现出一致的失活构象。在解析多种药物调控Cav1.2作用机制的过程中,作者获得了三个重要的非预期发现:
一是尽管Cav1.2 与Cav1.3同属于L型钙离子通道,在功能及序列上高度同源,但Cav1.2在部分结构特性上更接近于神经钙离子通道Cav2.2/Cav2.3。具体而言,Cav1.2,Cav2.2,Cav2.3的电压感受结构域II (VSDII)处于down构象;Cav1.1,Cav1.3的VSDII则处于up构象。
二是该研究解析了眼镜蛇毒素calciseptine致死的分子机制,颠覆了以往对动物毒素调控离子通道功能的认知。经典的动物毒素结合模式一般是通过结合在离子孔结构域阻碍离子运输,或者结合在电压感受结构域变构调控离子通道功能。在本工作中,Calciseptine结合在Cav1.2离子孔外周的肩膀区域,这种崭新的结合模式稳定了Cav1.2通道失活状态的构象,导致蛋白功能抑制。毒素及蛋白定点突变电生理研究进一步验证了该结合模式。
三是该研究在解析胃肠道解痉剂匹维溴铵调控机制时,发现了Cav1.2通道的全新失活构象。在该构象中,VSDII呈现up状态,离子孔扩大,选择性滤器(SF)构象改变。与此同时,重复单元III的S4-S5与S5两个α螺旋元件融合成单个螺旋,导致细胞内孔(Intracellular gate)变宽。除匹维溴铵外,氨氯地平等其他药物分子不能结合该构象。通过分子动力学模拟证实,这个孔道结构域变大的构象仍不能通透钙离子,通道蛋白处于失活状态。

据悉,这是高帅教授、姚霞教授在Nature(2021)、Cell Research(2022)、Cell(2022)、Nature Communications(2022)杂志发表钙离子通道镇痛药物齐考诺肽、抗晕动症药物桂利嗪,丙肝神药索非布韦副反应作用机制后,在该领域的又一系统性、突破性进展,为钙离子通道蛋白新型靶向药物研发奠定了重要的理论基础。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)01106-6
(供图:药学院 学生编辑:彭潇仪 编辑:张丽平)