新闻网讯(通讯员化苑)近日,《美国化学会志》(J.Am.Chem.Soc.)在线发表化学与分子科学学院教授王春江、副教授董秀琴课题组在铱催化不对称串联反应方面的最新研究进展。论文题为“Iridium-Catalyzed Asymmetric Cascade Allylation/Retro-Claisen Reaction”(《铱催化不对称串联烯丙基化/Retro-Claisen反应》)。化学与分子科学学院博士生易智远为论文第一作者,王春江和董秀琴为论文的共同通讯作者。
手性3-羟甲基戊烯类化合物是许多具有重要生物活性的天然产物和潜在手性药物分子的关键结构单元,也是一些重要手性分子的合成前体,目前关于高效合成该类手性骨架的报道比较少,发展高效、绿色、实用的合成方法具有非常重要的意义。但是该类手性化合物的合成需要解决两个挑战性难题:一是有序引入羰基、烯基和羟基等多个官能团;而是实现不对称转化过程中所涉及到的区域选择性、化学选择性及立体选择性的调控。
不对称催化串联反应具有合成效率高、选择性控制好、简化合成步骤等优点,是合成官能团多样性的复杂手性分子的重要途径。研究人员以商品化、价廉易得的β-二酮和环状乙烯基碳酸酯(VEC)为原料,通过巧妙设计成功开发了铱催化不对称串联烯丙基化/Retro-Claisen反应,以良好的产率和优异的对映选择性顺利实现一系列多官能团化的手性3-羟甲基戊烯衍生物(高达98%产率,>99%ee)。
该合成策略还能适用于一系列β-位上含有不同吸电子官能团的酮类化合物,具有很好的官能团适用性和底物普适性。同时,该反应在克级规模下能顺利进行,反应收率和对映选择性保持。为了进一步体现该方法学在合成上的应用价值,对反应产物手性3-羟甲基戊烯衍生物进行氢化、环丙烷化、硼氢化和烯烃复分解等一系列衍生化。值得注意的是,以该方法为关键步骤,简洁高效合成了重要手性原料(S)-Taniguchi内酯,并实现了天然产物金雀花碱Cytisine手性关键中间体的催化不对称合成。
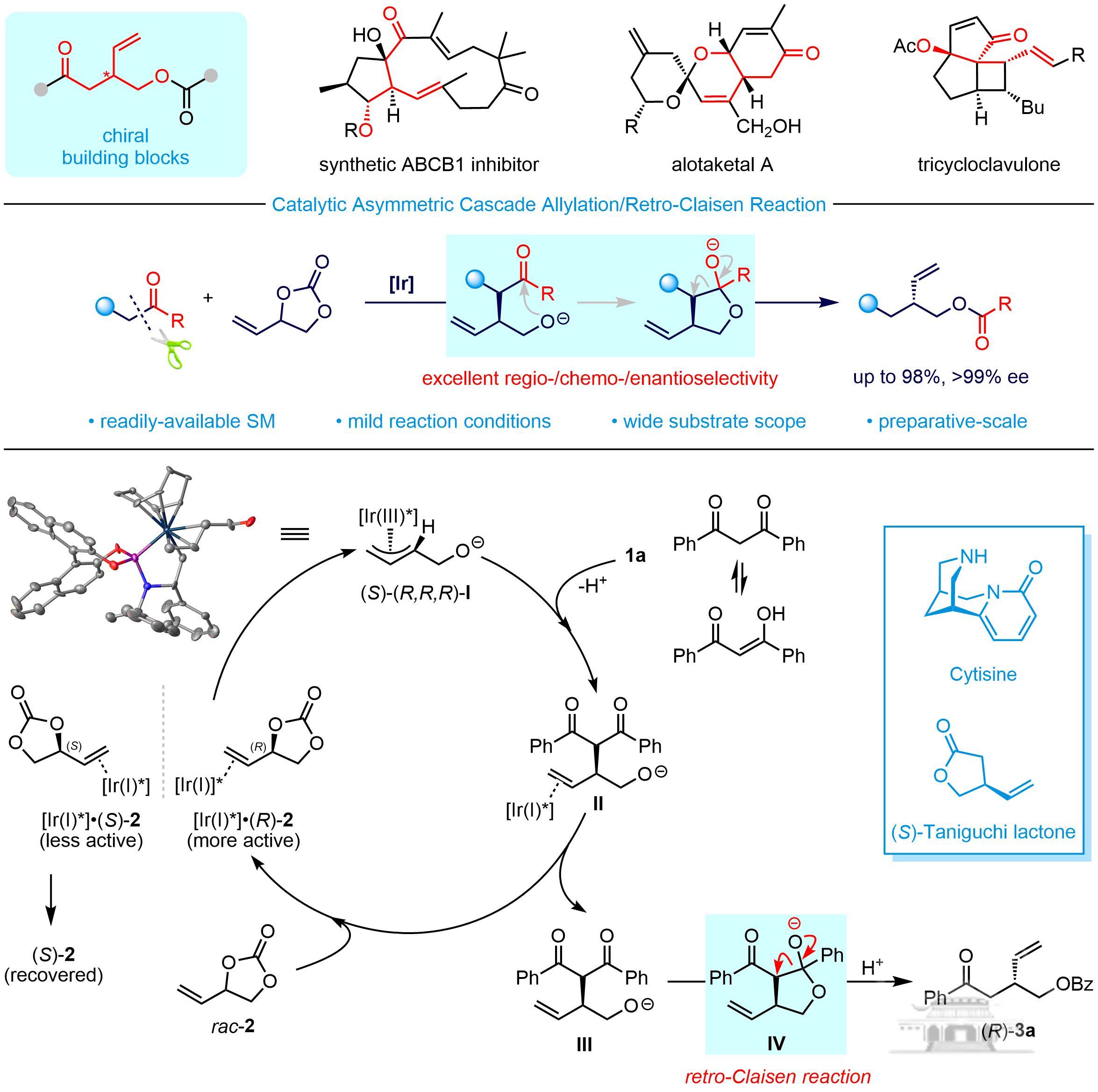
研究人员还对反应机理进行了深入研究和探讨,在一系列控制实验结果的基础上提出了合理的反应路径,并对非对称的β-二酮类化合物在反应中所展示的特殊的区域选择性给出符合Curtin-Hammett原理的解释。
该研究得到了国家自然科学基金委项目、湖北省自然科学基金重点类项目、中央高校基本科研业务费和武汉大学科研公共服务条件平台的支持。
论文链接:https://pubs.acs.org/doi/pdf/10.1021/jacs.2c08811
(供图:化学与分子科学学院 编辑:相茹)