新闻网讯(通讯员医研轩)近日,综合性期刊National Science Review(影响因子:20.7)在线发表武汉大学医学研究院/免疫与代谢前沿科学中心/泰康生命医学中心/病毒学国家重点实验室/中南医院殷昊教授团队的最新研究成果,论文题目为Minimizing the ratio of ionizable lipid in lipid nanoparticles forin vivobase editing。博士生陈秋冰为第一作者,殷昊为论文通讯作者。
该工作研发一类新型多羟基可电离脂质(HTO12分子),其具备与国际mRNA疗法领军企业莫德纳的商业化制剂SM-102相当的体内递送效率,并倍数降低总脂质投入量,可减少由脂质引起的安全性风险。脂质纳米颗粒(LNP)作为siRNA和mRNA的有效载体已被临床使用。在构建LNP成分中,可电离脂质被认为是决定RNA递送效率的关键因素,其稳定RNA分子封装,并促进RNA在细胞内释放。然而,临床数据显示,接受LNP治疗的部分受试者会出现不同程度的不良反应,包括但不限于发烧、局部疼痛、肌酐暂时升高和心肌炎等症状。这些临床表现表明需要进一步优化LNP设计,以减少不良反应产生。可电离脂质分子与RNA之间形成的氢键等弱相互作用力或可提高LNP体内递送效率,但在LNP剂型中的作用尚无报道。
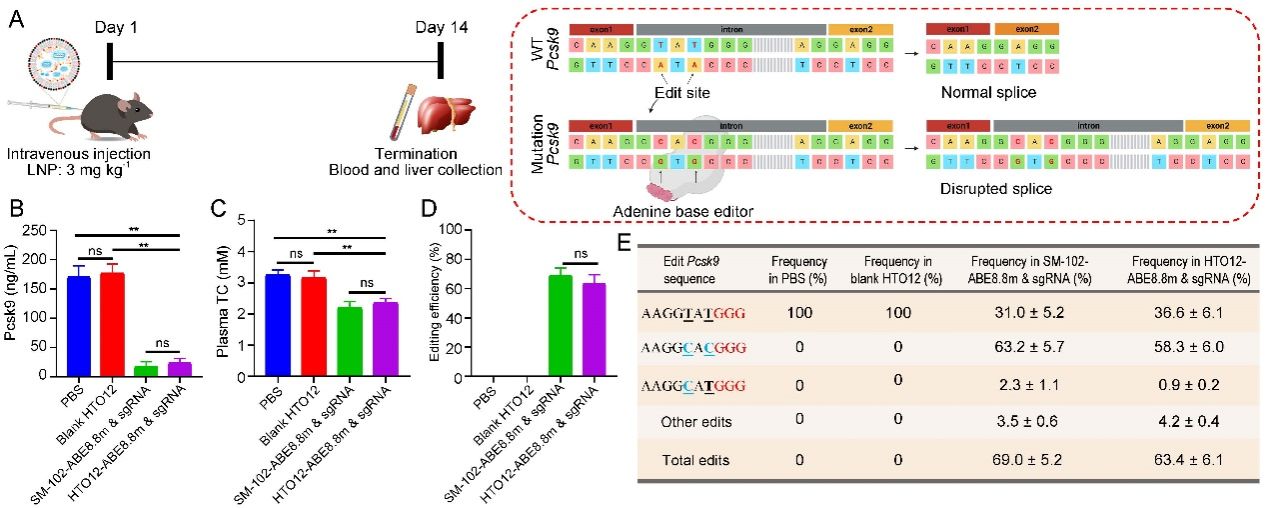
在本研究中,课题组设计并合成一类新型多羟基可电离脂质分子(HTO脂质分子),通过增加脂质分子中羟基的数量以加强可电离脂质分子与RNA之间的氢键作用力,提高了LNP的载药水平。使用HTO LNP体内递送表达萤火虫荧光素酶的mRNA(Luc mRNA),发现与商业化制剂SM-102 LNP递送效率相同,并且HTO12 LNP中可电离脂质与mRNA的比例相比于SM-102 LNP降低2.5倍。利用HTO12 LNP递送单碱基编辑工具进行基因治疗,实现高水平体内碱基编辑,显著降低血液中的Pcsk9蛋白和胆固醇水平。此类新型脂质载体在RNA疗法领域,包括RNA疫苗、基因编辑、蛋白替代疗法等方向具备应用前景。
据悉,本项工作得到国家重点研发计划、湖北省重点研发计划、国家自然科学基金、动物疫病预防控制国家重点实验室、中央高校科研业务费、武汉市应用基础前沿计划等资助。本研究得到武汉大学医学研究院仪器设备共享中心的大力支持。
原文链接:https://doi.org/10.1093/nsr/nwae135
(编辑:赵冀帆)