新闻网讯(通讯员赵珺)北京时间12月7日,Nature(《自然》杂志)在线发表了武汉大学医学研究院、教育部免疫与代谢前沿科学中心、中南医院医学研究院、泰康生命医学中心宋威团队与武汉大学中南医院老年医学科叶旭军团队关于肿瘤和肾脏互作的最新研究论文,题为A novel antidiuretic hormone governs tumour-induced renal dysfunction(《一种新型抗利尿素调控肿瘤导致的肾功能失调》)。武汉大学博士生徐文浩和博士后李戈锐为论文的共同第一作者,博士生陈媛为共同作者,宋威教授、叶旭军副教授为论文的通讯作者。武汉大学为唯一署名单位。

维持肾功能和液体平衡对脊椎动物和无脊椎动物应对各种生理病理应激至关重要。恶性肿瘤患者经常出现肾功能失调和少尿症,导致体液排出与毒素清除受损,严重危害机体健康。由于发病机制不明,透析是肿瘤相关肾功能失调的唯一治疗方案。之前的研究主要聚焦抗肿瘤药物的肾毒性,但近一半的实体瘤患者在确诊时和治疗前就出现肾功能失调;肿瘤相关免疫或炎症反应也被认为是潜在的致病因素。然而,恶性肿瘤是否及如何直接靶向肾脏、扰乱其生理功能,仍然大量未知。
肾小管上皮细胞对水分子的转运是机体排水的关键步骤,存在于不同物种中,包括人和果蝇,且受到激素调控。人和果蝇都有多种促进肾小管排水的利尿素,但其对立面抗利尿素的研究非常有限。果蝇中目前没有明确的抗利尿素,人体唯一的抗利尿素精氨酸血管加压素(AVP)也很难解释诸多生理病理调控。

从右至左分别为陈媛,徐文浩,宋威,叶旭军,李戈锐
针对这些问题,宋威和叶旭军团队通过保守的果蝇肿瘤模型和高通量体内筛选,鉴定了果蝇中第一例抗利尿激素——F亚型离子转运肽(ITPF),并揭示它由恶性肿瘤和肠道内分泌细胞分泌,直接作用于果蝇马氏管(类似于人的肾小管)破坏其排水功能,导致严重的体液潴留。具体分子机制包括ITPF直接激活马氏管星状上皮细胞中的G蛋白偶联受体TkR99D及其下游NOS-cGMP信号通路,抑制液体排出。另一方面,他们还首次发现哺乳动物神经激肽3受体(NK3R)作为果蝇TkR99D的同源物在肾小管上皮细胞中表达,通过小分子药物阻断NK3R有效改善多种恶性肿瘤导致的小鼠肾小管功能障碍。
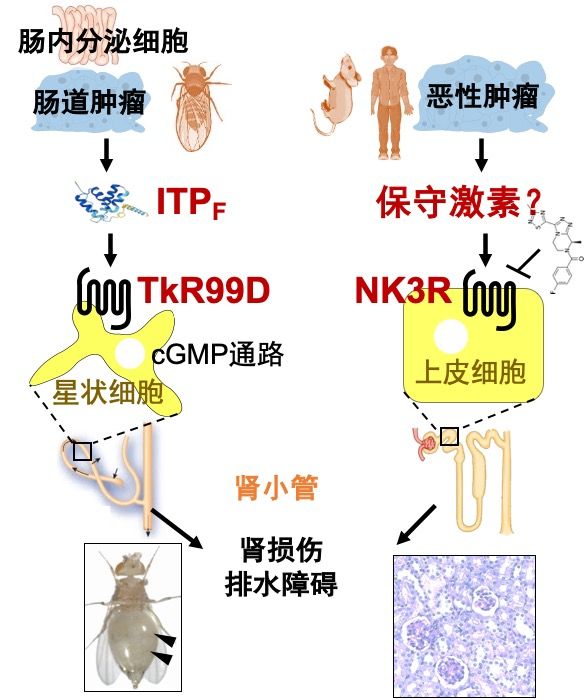
因此,该工作鉴定了一种跨物种广谱、介导肿瘤和肾脏互作的新型抗利尿通路,并为癌症相关肾功能失调提供了新的治疗靶点。该工作得到了科技部国家重点研发计划、国家自然科学基金重大研究计划和面上项目、中央高校基本科研业务费、武汉大学“双一流”建设专项人才经费及医学研究院仪器设备共享中心的支持。
据了解,宋威团队长期专注于器官交流和代谢免疫的调控,结合果蝇、小鼠和临床观察研究分泌蛋白介导肠道或恶性肿瘤对各组织器官的远程调控,揭示癌症恶病质、肥胖和糖尿病等重大疾病的全新发病机理和治疗靶点。叶旭军团队聚焦于衰老相关慢性病的基础与临床研究,包括肺纤维化、肾损伤以及心血管代谢性疾病等,主持国家级科研及教学项目7项,研究成果曾获湖北省科技进步二等奖和科技推广三等奖。
论文链接:https://www.nature.com/articles/s41586-023-06833-8
(摄影:曹海钢 编辑:赵冀帆)